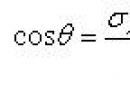Основные понятия химической термодинамики
Химические процессы могут протекать с изменением химического состава вещества (химические реакции) и без его изменения (фазовые переходы). Совокупность веществ, находящихся во взаимодействии и выделенных из окружающего пространства (мысленно) называется системой . Например: атом водорода (система из ядра и электрона), водный раствор различных солей и т.д.
В зависимости от характера взаимодействия системы с окружающей средой различают: открытые или незамкнутые (происходит обмен теплом, энергией и веществом с окружающей средой), закрытые или замкнутые (происходит обмен теплом и энергией с окружающей средой, но нет обмена веществом) и изолированные (отсутствие массо- и теплопереноса между системой и окружающей средой) (рис. 1).
Рис. 1. Примеры закрытой (а), открытой (б) и изолированной систем (в).
Состояние системы определяется совокупностью ее свойств и характеризуется термодинамическими параметрами температурой, давлением и объемом (T, p, V). Любое изменение одного или нескольких параметров системы называется термодинамическим процессом. Так, повышение температуры приводит к изменению внутренней энергии системы (U).
ОПРЕДЕЛЕНИЕ
Внутренняя энергия – суммарных запас молекул, атомов, электронов и ядер, составляющих систему, складывающийся из кинетической энергии этих частиц и энергии взаимодействия между ними.
Нельзя рассчитать или измерить абсолютное значение U. Возможно определить изменение внутренней энергии (ΔU) в результате какого-либо процесса. ΔU любой системы при переходе из одного состояния в другое не зависит от пути перехода, а определяется начальным и конечным положениями системы. Это означает, что внутренняя энергия системы — функция состояния.
ΔU = U 2 – U 1 ,
Где 1 и 2 – символы начального и конечного состояния системы.
Первое начало термодинамики: сообщенное системе тепло Q расходуется на приращение внутренней энергии и на совершение работы (А) против внешних сил:
Следует отметить, что А и Q не являются функциями состояния, т.е. не зависят от пути протекания процесса.
В термодинамике нередко вводят величины, которые тождественны сумме нескольких термодинамических параметров. Такая замена существенно облегчает расчеты. Так, функцию состояния, равную U + pV, называют энтальпией (Н):
При постоянном давлении (изобарный процесс) и в отсутствии других работ, кроме работы расширения, теплота равна изменению энтальпии:
Q p = ΔU + pΔV = ΔH
Если процесс идет при постоянном объеме (изохорный) и в отсутствие других работ, выделившаяся или поглотившаяся теплота соответствует изменению внутренней энергии:
Основы термохимии
Раздел химической термодинамики, изучающий теплоты химических реакций и их зависимость от различных физико-химических параметров, называют термохимией. В термохимии пользуются термохимическими уравнениями реакций, в которых указывают агрегатное состояние вещества, а тепловой эффект реакции рассматривается как один из продуктов. Например:
2H 2(g) + O 2(g) = H 2 O (g) + 242 кДж,
Что означает, что при образовании 1 моль воды в газообразном состоянии выделяется 242 кДж тепла. При этом изменение энтальпии ΔH = − 242 кДж.
Противоположные знаки Q и ΔH свидетельствуют о том, что в первом случае – это характеристика процессов в окружающей среде, а во втором – в системе. При экзотермическом процессе Q > 0, ΔH < 0, а при эндотермическом – наоборот.
Тепловые эффекты можно не только измерять, но и рассчитывать с помощью закона Гесса: тепловой эффект химической реакции, протекающей при постоянных p и V не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Следствия закона Гесса
Из закона Гесса есть 5 следствий:
1) Тепловой эффект образования 1 моль сложного вещества из простых веществ, при стандартный условиях, называется теплотой образования этого вещества – ΔH 0 f . Так, например, ΔH 0 f (CO 2) из С (s) и O 2(g) будет равен −393,51 кДж.
2) Стандартные теплоты образования простых веществ равны нулю.
3) Стандартный тепловой эффект химической реакции (ΔH 0) равен разности между суммой теплот образования продуктов реакции (с учетом стехиометрических коэффициентов) и суммой теплот образования исходных веществ (с учетом стехиометрических коэффициентов):
ΔH 0 = Σ ΔH 0 f (продукты) − Σ ΔH 0 f (реагенты)
Например, для реакции:
2H 2 S (g) + 3O 2(g) = 2SO 2(g) + 2H 2 O (aq)
ΔH 0 = Σ (2 × ΔH 0 f (SO 2) + 2 × ΔH 0 f (H 2 O)) – Σ (2 ΔH 0 f (H 2 S) +0)
4) Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов
5) С термохимическими уравнениями можно производить все алгебраические действия, например:
A= B + C + 400 кДж
B + D = A − 200 кДж
Сложив эти уравнения получим
A + B + D = B + C + A + 200 кДж
D = C + 200 кДж
ΔH 0 = − 200 кДж
Энтропия. Направление химических процессов. Энергия Гиббса
ОПРЕДЕЛЕНИЕ
Энтропия (S) – свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса:
Например, при испарении воды в условиях кипения (Т =373 К, р=1 атм) изменение энтропии равно ΔS = ΔH исп /373 = 44000/373 = 118 кДж/(моль × К).
На основании о стандартной энтропии веществ (S 0) можно рассчитать изменение энтропии различный процессов:
Δ r S 0 = Σ n i S 0 − Σ n j S 0 ,
где i – продукты реакции, j – исходные вещества.
Энтропия простых веществ не равна нулю.
Рассчитав Δ r S 0 и Δ r H 0 можно сделать вывод об обратимости реакции. Так, если Δ r S 0 и Δ r H 0 больше нуля или Δ r S 0 и Δ r H 0 меньше нуля, то реакция носит обратимый характер.
Существует функция, которая связывает изменение энтальпии и энтропии и отвечает на вопрос о самопроизвольности протекания реакции – энергия Гиббса (G).
ΔG = ΔH − Т × ΔS
Δ r G 0 = Δ r H 0 − Т × Δ r S 0
О направлении протекания химической реакции судят по величине Δ r G 0 . Если Δ r G 0 <0, то реакция идет в прямом направлении, а если Δ r G 0 > 0 – в обратном. С наибольшей вероятностью из 2х реакций будет протекать та, у которой меньше значение Δ r G 0 .
Таблица 1. Условия самопроизвольности протекания химических реакций
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 1
| Задание | Рассчитайте изменение энергии Гиббса (ΔG
o 298) для процесса:
Na 2 O(т) + H 2 O(ж) → 2NaOH(т) Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298К? Необходимые справочные данные: ΔG o f (NaOH,т) = –381,1 кДж/моль, ΔG o f (Na 2 O) = –378 кДж/моль, Δ G o f (H 2 O,ж) = –237 кДж/моль. |
| Решение | При стандартных условиях и
T=298К ΔG o
298 можно рассчитать как разность суммарной энергии Гиббса (ΔG
o f) образования продуктов реакции и суммарной энергии Гиббса образования исходных веществ:
ΔG o 298 = 2ΔG o f (NaOH,т) – [ΔG o f (Na 2 O,т) + Δ G o f (H 2 O,ж)] ΔG o 298 = 2(–381,1) –[–378 + (–237)] = –147,2 кДж. Значение ΔG o 298 отрицательно, поэтому самопроизвольное протекание реакции возможно. |
| Ответ | ΔG o 298 = –147,2 кДж, самопроизвольное протекание реакции возможно. |
На протяжении всей жизни мы постоянно сталкиваемся с физическими и химическими явлениями. Природные физические явления для нас столь привычны, что мы уже давно не придаём им особого значения. Химические реакции постоянно протекают в нашем организме. Энергия, которая выделяется при химических реакциях, постоянно используется в быту, на производстве, при запуске космических кораблей. Многие материалы, из которых изготовлены окружающие нас вещи, не взяты в природе в готовом виде, а изготовлены с помощью химических реакций. В быту для нас не имеет особого смысла разбираться в том, что же произошло. Но при изучении физики и химии на достаточном уровне без этих знаний не обойтись. Как отличить физические явления от химических? Существуют ли какие-либо признаки, которые могут помочь это сделать?
При химических реакциях из одних веществ образуются новые, отличные от исходных. По исчезновению признаков первых и появлению признаков вторых, а также по выделению или поглощению энергии мы заключаем, что произошла химическая реакция.
Если прокалить медную пластинку, на её поверхности появляется чёрный налёт; при продувании углекислого газа через известковую воду выпадает белый осадок; когда горит древесина, появляются капли воды на холодных стенках сосуда, при горении магния получается порошок белого цвета.
Выходит, что признаками химической реакций являются изменение окраски, запаха, образование осадка, появление газа.
При рассмотрении химических реакций, необходимо обращать внимание не только на то, как они протекают, но и на условия, которые должны выполняться для начала и течения реакции.
Итак, какие же условия должны быть выполнены для того, чтобы началась химическая реакция?
Для этого прежде всего необходимы реагирующие вещества привести к соприкосновению (соединить, смешать их). Чем более измельчены вещества, чем больше поверхность их соприкосновения, тем быстрее и активнее протекает реакция между ними. Например, кусковой сахар трудно поджечь, но измельчённый и распылённый в воздухе он сгорает за считанные доли секунды, образуя своеобразный взрыв.
С помощью растворения мы можем раздробить вещество на мельчайшие частицы. Иногда предварительное растворение исходных веществ облегчает проведение химической реакции между веществами.
В некоторых случаях соприкосновение веществ, например, железа с влажным воздухом, достаточно, чтобы произошла реакция. Но чаще одного соприкосновения веществ для этого недостаточно: необходимо выполнение ещё каких-либо условий.
 Так, медь не вступает в реакцию с кислородом воздуха при невысокой температуре около 20˚-25˚С. Чтобы вызвать реакцию соединения меди с кислородом, необходимо прибегнуть к нагреванию.
Так, медь не вступает в реакцию с кислородом воздуха при невысокой температуре около 20˚-25˚С. Чтобы вызвать реакцию соединения меди с кислородом, необходимо прибегнуть к нагреванию.
На возникновение химических реакций нагревание влияет по – разному. Для одних реакций требуется непрерывное нагревание. Прекращается нагревание – прекращается и химическая реакция. Например, для разложения сахара необходимо постоянное нагревание.
В других случаях нагревание требуется лишь для возникновения реакции, оно даёт толчок, а далее реакция протекает без нагревания. Например, такое нагревание мы наблюдаем при горении магния, древесины и других горючих веществ.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Организм совершает работу, затрачивая внутреннюю энергию, запасенную в виде энергии химического взаимодействия атомов составляющих его веществ. Математическое выражение -ДE = -Q - W первого начала термодинамики определяет точное соотношение между расходом внутренней энергии системы ДЕ, работой W, совершаемой системой, и энергией Q, которая теряется в виде теплоты. Однако из первого начала термодинамики нельзя определить часть расходуемой внутренней энергии, которая может быть преобразована в работу. Теоретические оценки затрат осуществляются на основе второго начала термодинамики. Этот закон накладывает строгие ограничения на эффективность преобразования энергии в работу и, кроме того, позволяет ввести критерии возможности самопроизвольного протекания того или иного процесса. Процесс называется самопроизвольным, если он осуществляется без каких-либо воздействий, когда система предоставлена самой себе. Существуют процессы, при которых внутренняя энергия системы не меняется (ДЕ = 0). К таким процессам относится, например, ионизация уксусной кислоты в воде. Целый ряд самопроизвольных процессов протекает с увеличением внутренней энергии (ДЕ > 0). Сюда относятся, в частности, типичные реакции образования бионеорганических соединений альбумина (белок плазмы крови) с ионами металлов, например Сu2+. Изменение внутренней энергии АЕ для закрытых систем не может служить критерием самопроизвольного протекания процессов. Следовательно, первого начала термодинамики, из которого получен этот критерий, недостаточно для решения вопроса о самопроизвольности, равно как и об эффективности процессов. Решение этих вопросов достигается с помощью второго начала термодинамики. Для формулировки второго начала термодинамики необходимо ввести понятия обратимого и необратимого в термодинамическом смысле процессов.Если система находится в равновесии, это состояние поддерживается как угодно долго при неизменности внешних условий. При изменении внешних условий состояние системы может меняться, т. е. в системе может протекать процесс. Процесс называется термодинамически обратимым, если при переходе из начального состояния 1 в конечное состояние 2 все промежуточные состояния оказываются равновесными. Процесс называется термодинамически необратимым, если хоть одно из промежуточных состояний не-равновесно. Обратимый процесс можно осуществить лишь при достаточно медленном изменении параметров системы - температуры, давления, концентрации веществ и др. Скорость изменения параметров должна быть такой, чтобы возникающие в ходе процесса отклонения от равновесия были пренебрежимо малы. Следует отметить, что с обратимостью связана важная проблема медицины - консервация тканей при низких температурах. Обратимые процессы являются предельным случаем реальных процессов, происходящих в природе и осуществляемых в промышленности или в лабораториях.
В качестве критерия самопроизвольности процессов в открытых и закрытых системах вводится новая функция состояния - энергия Гиббса. Эта функция получила название в честь великого американского физика Д. У. Гиббса (1839--1903), который вывел эту функцию, а затем использовал в термодинамических работах.Энергия Гиббса определяется через энтальпию Н и энтропию S с помощью соотношений:
G = H - S, ДG = ДH - ДS.
На основе энергии Гиббса второе начало термодинамики можно сформулировать следующим образом: в изобарно-изотермических условиях (р, Т = const) в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса системы уменьшается (ДG <0).В состоянии равновесия энергия Гиббса системы не ме-няется (G = const, AG = 0).
ДG < 0, р, Т = const. Из изложенного вытекает, что энергия Гиббса играет большую роль в изучении биоэнергетических процессов. С помощью этой функции состояния можно прогнозировать направление самопроизвольных процессов в биологических системах и рассчитывать мак-симально достижимый КПД.
Энергия Гиббса G так же, как и энтальпия Н, является функцией состояния системы. Поэтому изменение энергии Гиббса ДG может использоваться для характеристики химических превращений аналогично изменению энтальпии ДН. Уравнения реакции, для которых указывается соответствующее этим реакциям изменение энергии Гиббса, также называются термохимическими. Химические реакции, при протекании которых происходит уменьшение энергии Гиббса системы (ДG < 0) и совершается работа, называются экзергоническими. Реакции, в результате которых энергия Гиббса возрастает (ДG > 0) и над системой совершается работа, называются эндергоническими. Выведенная на основе второго начала термодинамики энергия Гиббса является функцией состояния. Следовательно, так же, как и для энтальпии, может быть сформулирован закон Гесса для энергии Гиббса в следующей форме: изменение энергии Гиббса при образовании заданных продуктов из данных реагентов при постоянных давлении и температуре не зависит от числа и вида реакций, в результате которых образуются эти продукты.Важный пример применения закона Гесса - расчет энергии Гиббса реакции окисления глюкозы дикислородом. Изменение энергии Гиббса в этой реакции при р = 101 кПа и Т = 298°К, определенное вне организма, равно ДG° = -2880 кДж/моль. Соответствующее термохимическое уравнение записывается в виде:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О, ДGp-я° = -2880 кДж/моль.
Свободная энергия Гиббса (или просто энергия Гиббса , или потенциал Гиббса , или термодинамический потенциал в узком смысле) - это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции.
аправление протекания химической реакции определяет энергия Гиббса (∆G). Еще энергию Гиббса называют изобарно - изотермическим потенциалом. Размерность энергии Гиббса кДж/моль.
При постоянном давлении и температуре (р=const, T=cons)t реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении в данных условиях невозможно, а возможно протекание обратного процесса. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.
Изменение энергии Гиббса в ходе химической реакции (∆ ) не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакцииравно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции
aA + bB = сС + dD
где ∆G 0 – стандартная энергия Гиббса образования вещества, кДж/моль.
Энергия Гиббса образования простых веществ равна нулю. ∆ имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж.
Изменение стандартной энергии Гиббса химической реакции может быть также вычислено по уравнению:
∆ = ∆ – Т∆ , где
Т – абсолютная температура,
∆ – изменениеэнтропии.
∆H х.р. – изменениеэнтальпии.
При химическом взаимодействии одновременно изменяется энтальпия, характеризующая теплосодержание системы, и энтропия, характеризующая стремление системы к беспорядку. Уменьшение энтальпии и рост энтропии - две движущих силы любого химического процесса. В состоянии равновесия ∆ =0, значит:
∆ – Т∆ =0 и
Если пренебречь изменениями ∆H 0 х.р. и ∆S 0 х.р с увеличением температуры, то можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
Т равн. =
Многие химические реакции протекают самопроизвольно, т.е. без затрат энергии извне. Одной из движущих сил самопроизвольного химического процесса является уменьшение энтальпии системы, т.е. экзотермический тепловой эффект реакции. Другой – стремление частиц (молекул, ионов, атомов) к хаотическому движению, беспорядку. Мерой хаотичности, неупорядоченности состояния системы служит термодинамическая функция, называемая энтропией (S).
При переходе системы из более упорядоченного состояния в менее упорядоченное состояние (нагревание, испарение, плавление) энтропия возрастает (DS>0). В случае перехода системы из менее упорядоченного состояния в более упорядоченное (охлаждение, конденсация, кристаллизация) энтропия системы уменьшается (DS<0).
В изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии (S>0) – это суть второго закона термодинамики.
Энтропия вещества в стандартном состоянии называется стандартной энтропией (So) и имеет единицу измерения Дж/моль К
Энтропия вещества в газообразном состоянии существенно выше, чем в жидком и твердом состояниях, поэтому об изменении энтропии в химической реакции судят по изменению числа молей газообразных веществ.
Возможность самопроизвольного протекания химического процесса определяется двумя факторами:
Стремлением к образованию прочных связей между частицами, к возникновению более сложных веществ, что сопровождается понижением энергии системы – энтальпийный фактор (DH<0);
Стремлением к разъединению частиц, к беспорядку, что характеризуется возрастанием энтропии – энтропийный фактор (DS>0).
Эти факторы объединяет функция, называемая энергией Гиббса (DG), равная: DG = DH - T DS. (D- это дельта типа, треугольник короче)
Изменение энергии Гиббса служит критерием самопроизвольного протекания химической реакции:
Химическая реакция принципиально возможна, если энергия Гиббса в ходе реакции уменьшается (DG<0);
Химическая реакция не может протекать самопроизвольно, если энергия Гиббса системы возрастает (DG>0), протекает обратная реакция;
Химическая реакция может протекать как в прямом, так и в обратном направлении, т.е. система находится в состоянии равновесия (DG=0).
Из уравнения DG=DH-T DS следует:
Если DН<0 и DS>0, то всегда DG<0, т.е. реакция с выделением теплоты и увеличением степени беспорядка возможна при любых температурах;
Если DH>0 и DS<0, то всегда DG>0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях;
DH>0, DS<0. Реакция будет протекать в прямом направлении только при условии, что |T DS|>|DH|. Эти реакции протекают при высокой температуре;
DH<0, DS>0. Условие самопроизвольного протекания реакции: |DH|>|T DS|. Такие реакции идут обычно при низких температурах.
Температуру, при которой происходит смена знака энергии Гиббса реакции, можно определить из условия равновесия:
Тр = DH/DS, где Тр – температура, при которой устанавливается равновесие.
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых в стандартных условиях, называется стандартной энергией Гиббса образования вещества (DGof). Стандартная энергия Гиббса образования простых веществ принимается равной нулю.
Стандартную энергию Гиббса химической реакции (DGor) можно рассчитать как сумму стандартных энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов .
Скорость химической реакции – это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
Закон действующих масс : зависимость скорости реакции от концентрации реагирующих веществ. Чем выше концентрация, тем большее число молекул содержится в объеме. Следовательно, возрастает число соударений, что приводит к увеличению скорости процесса.
Кинетическое уравнение – зависимость скорости реакции от концентрации.
Твердые тела равны 0
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Общий порядок реакции - это сумма показателей степеней концентрации в кинетическом уравнении.
Константа скорости реакции - коэффициент пропорциональности в кинетическом уравнении.
Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два - четыре раза
Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
Молекулы должны обладать необходимой энергией (энергией активации).
Молекулы должны быть правильно ориентированы относительно друг друга.
Энергия активации - минимальное количество энергии, которое требуется сообщить системе, чтобы произошла реакция.
Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции от температуры
![]()
A - характеризует частоту столкновений реагирующих молекул
R - универсальная газовая постоянная.
Влияние катализаторов на скорость реакции.
Катализатор – это вещество, изменяющее скорость химической реакции, но само в реакции не расходуется и в конечные продукты не входит.
При этом изменение скорости реакции происходит за счет изменения энергии активации, причем катализатор с реагентами образует активированный комплекс.
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами).
Гетерогенный катализ - реагент и катализатор находятся в разных фазах - газообразной и твердой.
Гомогенный катализе - реагенты (реактивы) и катализатор находятся в одной фазе - например, оба являются газами или оба растворены в каком-либо растворителе.
Условия химического равновесия
состояние химического равновесия сохраняется до тех пор, пока остаются неизменными условия реакции: концентрация, температура и давление.
Принцип Ле-Шателье: если на систему, находящуюся в равновесии оказано какое-либо внешнее воздействии, то равновесии сместится в сторону той реакции, которое это действие будет ослаблять.
Константа равновесия – это мера полноты протекания реакции, чем больше величина константы равновесия, тем выше степень превращение исходных веществ в продукты реакции.
|
К р =С пр \С исх |
ΔG<0 К р >1 С пр > С исх
ΔG>0 К р <1 С пр <С исх