Промежуточное состояние вещества между состоянием реального газа и жидкостью принято называть парообразным или просто паром. Превращение жидкости в пар представляет собой фазовый переход из одного агрегатного состояния в другое. При фазовом переходе наблюдается скачкообразное изменение физических свойств вещества.
Примерами таких фазовых переходов является процесс кипения жидкости с появлением влажного насыщенного пара и последующим переходом его в лишенный влаги сухой насыщенный пар или обратный кипению процесс конденсации насыщенного пара.
Одно из основных свойств сухого насыщенного пара заключается в том, что дальнейший подвод теплоты к нему приводит к возрастанию температуры пара, т. е. перехода его в состояние перегретого пара, а отвод теплоты — к переходу в состояние влажного насыщенного пара. В
Фазовые состояния воды
Рисунок 1. Фазовая диаграмма для водяного пара в T, s координатах.
Область I – газообразное состояние (перегретый пар, обладающий свойствами реального газа);
Область II – равновесное состояние воды и насыщенного водяного пара (двухфазное состояние). Область II также называют областью парообразования;
Область III – жидкое состояние (вода). Область III ограничена изотермой ЕК;
Область IV – равновесное состояние твердой и жидкой фаз;
Область V – твердое состояние;
Области III, II и I разделены пограничными линиями AK (левая линия) и KD (правая линия). Общая точка K для пограничных линий AK и KD обладает особыми свойствами и называется критической точкой . Эта точка имеет параметры p кр , v кр и Т кр , при которых кипящая вода переходит в перегретый пар, минуя двухфазную область. Следовательно, вода не может существовать при температурах выше Т кр.
Критическая точка К имеет параметры:
p кр = 22,136 МПа; v кр = 0,00326 м 3 /кг; t кр = 374,15 °С.
Значения p, t, v и s для обеих пограничных линий приводятся в специальных таблицах термодинамических свойств водяного пара.
Процесс получения водяного пара из воды
На рисунках 2 и 3 изображены процессы нагрева воды до кипения, парообразования и перегрева пара в p, v — и T, s -диаграммах.
Начальное состояние жидкой воды, находящейся под давлением p 0 и имеющей температуру 0 °С, изображается на диаграммах p, v и T, s точкой а . При подводе теплоты при p = const температура ее увеличивается и растет удельный объем. В некоторый момент температура воды достигает температуры кипения. При этом ее состояние обозначается точкой b. При дальнейшем подводе теплоты начинается парообразование с сильным увеличением объема. При этом образуется двухфазная среда — смесь воды и пара, называемая влажным насыщенным паром . Температура смеси не меняется, так как тепло расходуется на испарение жидкой фазы. Процесс парообразования на этой стадии является изобарно-изотермическим и обозначается на диаграмме как участок bc . Затем в некоторый момент времени вся вода превращается в пар, называемый сухим насыщенным . Это состояние обозначается на диаграмме точкой c .

Рисунок 2. Диаграмма p, v для воды и водяного пара.

Рисунок 3. Диаграмма T, s для воды и водяного пара.
При дальнейшем подводе теплоты температура пара будет увеличиваться и будет протекать процесс перегрева пара c — d . Точкой d обозначается состояние перегретого пара. Расстояние точки d от точки с зависит от температуры перегретого пара.
Индексация для обозначения величин, относящихся к различным состояниям воды и пара:
- величина с индексом «0» относится к начальному состоянию воды;
- величина с индексом «′» относится к воде, нагретой до температуры кипения (насыщения);
- величина с индексом «″» относится к сухому насыщенному пару;
- величина с индексом «x » относится к влажному насыщенному пару;
- величина без индекса относится к перегретому пару.
Процесс парообразования при более высоком давлении p 1 > p 0 можно отметить, что точка a, изображающая начальное состояние воды при температуре 0 °С и новом давлении, остается практически на той же вертикали, так как удельный объем воды почти не зависит от давления.
Точка b′ (состояние воды при температуре насыщения) смещается вправо на p, v -диаграмме и поднимается вверх на T,s -диаграмме. Это потому, что с увеличением давления увеличивается температура насыщения и, следовательно, удельный объем воды.
Точка c′ (состояние сухого насыщенного пара) смещается влево, т. к. с увеличением давления удельный объем пара уменьшается, несмотря на увеличение температуры.
Соединение множества точек b и c при различных давлениях дает нижнюю и верхнюю пограничные кривые ak и kc. Из p, v -диаграммы видно, что по мере увеличения давления разность удельных объемов v″ и v′ уменьшается и при некотором давлении становится равной нулю. В этой точке, называемой критической, сходятся пограничные кривые ak и kc. Состояние, соответствующее точке k , называется критическим. Оно характеризуется тем, что при нем пар и вода имеют одинаковые удельные объемы и не отличаются по свойствам друг от друга. Область, лежащая в криволинейном треугольнике bkc (в p, v -диаграмме), соответствует влажному насыщенному пару.
Состояние перегретого пара изображается точками, лежащими над верхней пограничной кривой kc .
На T, s -диаграмме площадь 0abs′ соответствует количеству теплоты, необходимого для нагрева жидкой воды до температуры насыщения.
Количество подведенной теплоты, Дж/кг, равное теплоте парообразования r, выражается площадью s′bcs, и для нее имеет место соотношение:
r = T (s″ — s′ ).
Количество подведенной теплоты в процессе перегрева водяного пара изображается площадью s″cds .
На T, s -диаграмме видно, что по мере увеличения давления теплота парообразования уменьшается и в критической точке становиться равной нулю.
Обычно T, s -диаграмма применяется при теоретических исследованиях, так как практическое использование ее сильно затрудняется тем, что количества теплоты выражаются площадями криволинейных фигур.
По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
И здесь уже можно перейти ко второй категории. Под словом «лед» мы привыкли понимать твердое фазовое состояние воды. Но помимо нее замораживанию подвергаются и другие вещества. Таким образом, лед можно различать по химическому составу исходного вещества, например, углекислый, аммиачный, метановый лед и другие.
В-третьих, различают кристаллические решетки (модификации) водяного льда, образование которых обусловлено термодинамическим фактором. Вот о них-то мы и поговорим немного в этой заметке.

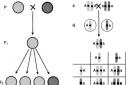
В статье Лед мы с вами остановились на том, как происходит перестройка структуры воды с изменением ее агрегатных состояний, и затронули кристаллическое строение обыкновенного льда. Благодаря внутреннему устройству самой молекулы воды и водородным связям, соединяющим все молекулы в упорядоченную систему, образуется гексагональная (шестиугольная) кристаллическая решетка льда. Ближайшие друг к другу молекулы (одна центральная и четыре угловых) расположены в форме трехгранной пирамиды, или тетраэдра, который лежит в основе гексагональной кристаллической модификации (илл.1 ).
Кстати , расстояние между мельчайшими частицами вещества измеряются в нанометрах (нм) или ангстремах (по имени шведского физика XIX века Андерса Йонаса Ангстрема; обозначается символом Å). 1 Å = 0,1 нм = 10−10 м.

Такое шестиугольное строение обыкновенного льда распространяется на весь его объем. Наглядно в этом можно убедиться невооруженным глазом: зимой во время снегопада поймайте снежинку на рукав одежды или на перчатку и приглядитесь к ее форме – она шестилучевая или шестиугольная. Это характерно для каждой снежинки, но при этом ни одна снежинка никогда не повторяет другую (подробнее об этом в нашей статье ). И даже крупные кристаллы льда своей внешней формой отвечают внутреннему молекулярному строению (илл.2 ).

Мы уже говорили, что переход вещества, в частности воды, из одного состояния в другое осуществляется при наличии определенных условий. Привычный лед образуется при температуре от 0°C и ниже и при давлении в 1 атмосферу (нормальное значение). Следовательно, для появления иных модификаций льда требуется изменение этих значений, и в большинстве случаев наличие низких температур и высокого давления, при которых происходит изменение угла водородных связей и реконструкция всей кристаллической решетки.

Каждая модификация льда относится к определенной сингонии – группе кристаллов, в которых элементарные ячейки обладают одной и той же симметрией и системой координат (оси XYZ). Всего же различают семь сингоний. Характеристики каждой из них представлены на иллюстрациях 3-4 . А чуть ниже дано изображение основных форм кристаллов (илл.5 )

Все модификации льда, отличающиеся от обыкновенного, были получены в лабораторных условиях. О первых полиморфных структурах льда стало известно в начале XX века стараниями ученых Густава Таммана (Gustav Heinrich Tammann) и Перси Бриджмена (Percy Williams Bridgman) . Диаграмма модификаций, составленная Бриджменом, периодически дополнялась. Новые модификации выявляли из полученных ранее. Последние изменения в диаграмму были внесены уже в наше время. На данный момент получено шестнадцать кристаллических типов льда. Каждый тип имеет свое наименование и обозначается римской цифрой.
Мы не будем вникать глубоко в физические характеристики каждого молекулярного типа водяного льда, чтобы не утомлять вас, уважаемые читатели, научными подробностями, отметим только основные параметры.

Обыкновенный лед носит наименование лед Ih (приставка «h» означает гексагональную сингонию). На иллюстрации 7 представлена его кристаллическая структура, состоящая из шестиугольных связок (гексамеров), которые отличаются по форме – одна в виде шезлонга (англ. chair-form ), другая в виде ладьи (boat-form ). Эти гексамеры формируют трехмерную секцию – два «шезлонга» находятся по горизонтали вверху и внизу, а три «ладьи» занимают вертикальное положение.

На пространственной схеме показан порядок в расположении водородных связей льда Ih , но в действительности связи выстраиваются случайным образом. Впрочем, ученые не исключают, что водородные связи на поверхности гексагонального льда более упорядочены, чем внутри структуры.

Элементарная ячейка гексагонального льда (т.е. минимальный объем кристалла, повторное воспроизведение которого в трех измерениях, образует всю кристаллическую решетку в целом) включает в себя 4 молекулы воды. Размеры ячейки составляют 4,51 Å по сторонам a,b и 7.35 Å по стороне с (сторона, или ось с на схемах имеет вертикальное направление). Углы между сторонами, как видно из иллюстрации 4: α=β = 90°, γ = 120° . Расстояние между соседними молекулами равно 2.76 Å .

Гексагональные ледяные кристаллы образуют шестиугольные пластины и столбики; верхняя и нижняя грани в них являются базовыми плоскостями, а шесть одинаковых боковых граней называются призматическими (илл.10 ).
Минимальное количество молекул воды, необходимое для начала ее кристаллизации – около 275 (±25) . В значительной степени образование льда происходит на поверхности водной массы, граничащей с воздухом, нежели внутри нее. Кристаллы крупнозернистого льда Ih медленно формируются в направлении оси с, например, в стоячей воде они растут вертикально вниз от кристаллических пластинок, или в условиях, где рост в сторону затруднен. Мелкозернистый лед, образующийся в неспокойной воде или при быстром ее замерзании, имеет ускоренный рост, направленный от призматических граней. Температура окружающей воды определяет степень разветвленности кристаллической решетки льда.

Частицы растворенных в воде веществ, за исключением атомов гелия и водорода, чьи размеры позволяют им поместиться в полостях структуры, при нормальном атмосферном давлении исключаются из кристаллической решетки, вытесняясь на поверхность кристалла или, как в случае с аморфной разновидностью (об этом дальше в статье) образуя слои между микрокристаллами. Последовательные циклы замораживания-оттаивания воды могут быть использованы для очистки ее от примесей, например, газов (дегазация).
Наряду со льдом Ih существует также лед Ic (кубическая сингония ), правда, в природе образование этой разновидности льда изредка возможно только в верхних слоях атмосферы. Искусственно лед Ic получают путем моментального замораживания воды, для чего конденсируют пар на охлажденной от минус 80 до минус 110°С металлической поверхности при нормальном атмосферном давлении. В результате опыта на поверхность выпадают кристаллики кубической формы или в виде октаэдров. Создать кубический лед первой модификации из обычного гексагонального, понижая его температуру, не получится, а вот переход из кубического в гексагональный возможен при нагревании льда Ic выше минус 80°С .

В молекулярной структуре льда Ic угол водородных связей такой же, как и у обычного льда Ih – 109.5° . А вот шестигранное кольцо, образуемое молекулами, в решетке льда Ic присутствует только в форме шезлонга.
Плотность льда Ic равна 0.92 г/см³ при давлении в 1 атм. Элементарная ячейка в кубическом кристалле имеет 8 молекул и размеры: a=b=c = 6.35 Å, а ее углы α=β=γ = 90°.

На заметку. Уважаемые читатели, в данной статье мы неоднократно будем сталкиваться с показателями температуры и давления для того или иного типа льда. И если температурные значения, выраженные в градусах по Цельсию, всем понятны, то восприятие значений давления, возможно, для кого-то будет затруднено. В физике используются различные единицы для его измерения, но мы в нашей статье будем обозначать его в атмосферах (атм), округляя значения. Нормальное атмосферное давление составляет 1 атм, что равняется 760 мм ртутного столба, или чуть более 1 бара, или 0.1 МПа (мегапаскаль).
Как вы поняли, в частности, из примера со льдом Ic , существование кристаллических модификаций льда возможно в условиях термодинамического равновесия, т.е. при нарушении баланса температуры и давления, определяющего наличие какого-либо кристаллического вида льда, этот вид исчезает, переходя в иную модификацию. Диапазон этих термодинамических значений различается, для каждого вида он свой. Рассмотрим другие типы льда, не строго в номенклатурном порядке, а в связи с этими структурными переходами.
Лед II относится к тригональной сингонии. Он может образоваться из гексагонального типа при давлении около 3 000 атм и температуре около минус 75°С, или из другой модификации (лед V ), путем резкого снижения давления при температуре минус 35°С. Существование II типа льда возможно в условиях минус 170°С и давлении от 1 до 50 000 атм (или 5 гигапаскалей (ГПа)). По оценкам ученых, лед такой модификации, вероятно, может входить в состав ледяных спутников дальних планет Солнечной системы. Нормальное атмосферное давление и температура выше минус 113°C создают условия для перехода этого типа льда в обычный гексагональный лед.

На иллюстрации 13 показана кристаллическая решетка льда II . Видна характерная особенность структуры – своего рода, полые шестиугольные каналы, образуемые молекулярными связками. Элементарная ячейка (область, выделенная на иллюстрации ромбом) состоит из двух связок, которые смещены относительно друг друга, условно говоря, «по высоте». В результате образуется ромбоэдрическая система решетки. Размеры ячейки a=b=c = 7.78 Å; α=β=γ = 113.1°. В ячейке 12 молекул. Угол связей между молекулами (О–О–О) варьируется от 80 до 120°.

При нагреве II модификации можно получить лед III
, и наоборот, охлаждение льда III
превращает его в лед II
. Также лед III
образуется, когда температуру воды постепенно понижают до минус 23°С, увеличивая давление до 3 000 атм.
Как видно на фазовой диаграмме (илл. 6
), термодинамические условия для стабильного состояния льда III
, а также другой модификации – льда V
, невелики.
Льды III и V имеют четыре тройные точки с окружающими модификациями (термодинамические значения, при которых возможно существование разных состояний вещества). Тем не менее, льды II , III и V модификаций могут существовать в условиях нормального атмосферного давления и температуры минус 170°С, а нагревание их до минус 150°С приводит к образованию льда Ic .
По сравнению с другими модификациями высокого давления, известными в настоящее время, лед III
облает наименьшей плотностью – при давлении 3 500 атм. она равна 1.16 г/см³.
Лед III
является тетрагональной разновидностью кристаллизованной воды, но сама структура решетки льда III
имеет нарушения. Если обычно каждую молекулу окружают 4 соседние, то в данном случае этот показатель будет иметь значение 3.2, и кроме того поблизости могут находиться ещё 2 или 3 молекулы, которые не имеют водородных связей.
В пространственном построении молекулы образуют правосторонние спирали.
Габариты элементарной ячейки с 12 молекулами при минус 23°С и около 2800 атм: a=b = 6,66, c = 6,93 Å; α=β=γ = 90°. Угол водородных связей в диапазоне от 87 до 141°.
На иллюстрации 15 условно представлена пространственная схема молекулярного строения льда III . Молекулы (точки голубого цвета), распложенные ближе к зрителю, показаны крупнее, а водородные связи (линии красного цвета) соответственно толще.

А теперь, как говорится, по горячим следам, давайте сразу «перескочим» идущие после льда III
в номенклатурном порядке кристаллические модификации, и скажем несколько слов о льде IX
.
Этот вид льда, по сути, измененный лед III
, подвергнутый быстрому глубокому охлаждению от минус 65 до минус 108°С во избежание трансформирования его в лед II
. Лед IX
сохраняет устойчивость при температуре ниже 133°С и давлении от 2 000 до 4 000 атм. Его плотность и структура идентична III
виду, но в отличие от льда III
в структуре льда IX
имеется порядок в расположении протонов.
Нагревание льда IX
не возвращает его к исходной III
модификации, а превращает в лед II
. Размеры ячейки: a=b = 6,69, c = 6,71 Å при температуре минус 108°С и 2800 атм.
Кстати , роман писателя-фантаста Курта Воннегута (Kurt Vonnegut) 1963 г. «Колыбель для кошки» строится вокруг вещества, именуемого лед-девять, который описывается как искусственно полученный материал, представляющий большую опасность для жизни, так как вода при контакте с ним кристаллизуется, превращаясь в лед-девять. Попадание даже небольшого количества этого вещества в природную акваторию, выходящую к мировому океану, грозит замерзанием всей воды на планете, что в свою очередь означает гибель всего живого. В конце концов, так все и происходит.
Лед IV
представляет собой метастабильное (слабоустойчивое) тригональное образование кристаллической решетки. Его существование возможно в фазовом пространстве льдов III
, V
и VI
модификаций. Получить лед IV
можно из аморфного льда высокой плотности, медленно нагревая его, начиная от минус 130°С при постоянном давлении 8 000 атм.
Размер элементарной ромбоэдрической ячейки составляет 7.60 Å, углы α=β=γ = 70.1°. Ячейка включает в себя 16 молекул; водородные связи между молекулами асимметричные. При давлении 1 атм и температуре минус 163°С плотность льда IV равна 1.27 г/см³. Угол связей О–О–О: 88–128°.

Аналогично IV
типу льда образуется и лед XII
– путем нагревания высокоплотной аморфной модификации (об этом ниже) от минус 196 до минус 90°С при том же давлении 8 000 атм, но уже с более высокой скоростью.
Лед XII
также метастабилен в фазовой области V
и VI
кристаллических типов. Является разновидностью тетрагональной сингонии.
Элементарная ячейка содержит 12 молекул, которые, благодаря водородным связям с углами 84–135°, располагаются в кристаллической решетке, образуя двойную правостороннюю спираль. Ячейка имеет размеры: a=b = 8.27, c = 4.02 Å; углы α=β=γ = 90º. Плотность льда XII составляет 1.30 г/см³ при нормальном атмосферном давлении и температуре минус 146°С. Углы водородных связей: 67–132°.

Из открытых на сегодняшний день модификаций водяного льда самую сложную кристаллическую структуру имеет лед V
. 28 молекул составляют его элементарную ячейку; водородные связи пролегают через зазоры в других молекулярных соединениях, а некоторые молекулы образуют связи только с определенными соединениями. Угол водородных связей между соседними молекулами сильно различается – от 86 до 132°, поэтому в кристаллической решетке льда V
имеется сильное напряжение и огромный запас энергии.
Параметры ячейки при условиях нормального атмосферного давления и температуры минус 175°С: a= 9.22, b= 7.54, c= 10.35 Å; α=β = 90°, γ = 109,2 °.
Лед V
– это моноклинная разновидность, образуемая охлаждением воды до минус 20°С при давлении около 5 000 атм. Плотность кристаллической решетки с учетом давления 3 500 атм составляет 1.24 г/см³.
Пространственная схема кристаллической решетки льда V
типа показана на иллюстрации 18
. Серым контуром выделена область элементарной ячейки кристалла.

Упорядоченное расположение протонов в структуре льда V
делает его другой разновидностью, именуемой льдом XIII
. Данную моноклинную модификацию можно получить в результате охлаждения воды ниже минус 143°С с добавлением соляной кислоты (HCl) для облегчения фазового перехода, создавая давление 5 000 атм. Обратимый переход от XIII
типа к V
типу возможен в диапазоне температур от минус 193°С до минус 153°С.
Размеры элементарной ячейки льда XIII
слегка отличаются от V
модификации: а= 9,24, b= 7,47, c= 10.30 Å; α=β = 90°, γ= 109,7 ° (при 1 атм, минус 193°С). Количество молекул в ячейке то же – 28. Угол водородных связей: 82–135°.

В следующей части нашей статьи мы продолжим обзор модификаций водяного льда.
До встречи на страницах нашего блога!
Энциклопедичный YouTube
1 / 5
✪ Фазовые диаграммы
✪ Основы молекулярной | физики фазовая диаграмма воды | 1
✪ Фазовая плоскость
✪ Критическое состояние эфира.
✪ Закон Генри
Субтитры
Все рассмотренные фазовые переходы были изобарическими, в частности фазовые переходы воды в последних роликах происходили при давлении на уровне моря, равном одной атмосфере. В реальности всё по-другому. В реальном мире нигде не поддерживается постоянное давление в 1 атмосферу. 1 атмосфера – это давление на уровне моря на Земле. Давление зависит от размера планеты, от толщины атмосферы, от условий, в которых существуют газы, жидкости и твердые тела. Итак, перед вами фазовая диаграмма. Я запишу. «Фазовая диаграмма». Есть несколько форм записи диаграммы. Это – самая популярная из них, на которой показаны агрегатные состояния и переходы между ними при изменении температуры и давления. Это диаграмма для воды. По оси ординат отложена величина давления, Давайте-ка подпишу. По оси абсцисс – температура, а области диаграммы соответствуют различным агрегатным состояниям: твердое тело, жидкость... жидкость и, наконец, газ. Посмотрим, какому агрегатному состоянию соответствует температура в 0 градусов. Так вот, температура 0 градусов Цельсия и давление в 1 атмосферу. На графике им соответствует вот эта точка. Это граница между твердым телом и жидкостью при давлении в 1 атмосферу. Давление здесь равно 1 атмосфере. Это соответствует общеизвестному факту, что лед плавится при 0 градусов. Что случится, если мы увеличим давление? Лед станет плавиться при меньшей температуре. Увеличим давление, например, до 10 атмосфер, что в 10 раз больше, чем давление на уровне моря. Температура, при которой твердое тело переходит в жидкое состояние, уменьшится. Если давление уменьшить, например оказаться в Денвере, который на милю выше уровня моря, то температура замерзания увеличится где-то до 1 градуса. Здесь не совсем верный масштаб, но суть в том, что лед замерзнет быстрее, то есть при более высокой температуре, в Денвере, чем на дне Мертвого моря или в Долине смерти, которые расположены ниже уровня моря. Область справа от фиолетовой линии соответствует газу. Вернемся к атмосферному давлению. Это диаграмма для воды. Мы знаем, как она себя ведет при давлении в 1 атмосферу. Я проведу линию. При давлении в 1 атмосферу и температуре 0 градусов твердый лед превращается в жидкую воду. Двигаясь вдоль этой линии, мы попадаем в область высокой температуры. В этой точке графика температура равна 100 градусам. При такой температуре и давлении в 1 атмосферу жидкая вода превращается в водяной пар, то есть вскипает. Это температура кипения воды. Что, если снизить давление? Вновь отправимся в Денвер. Вот Денвер. Хотя нет, нужно что-то более наглядное. Пусть лучше это будет гора Эверест, там давление низкое. C понижением давления температура замерзания растет, а кипения – снижается, так что воду проще вскипятить на вершине Эвереста, чем у ее подножья или в низине Долины смерти. Представьте себе жидкость. В ней миллионы молекул, которые располагаются очень близко, но при этом обладают достаточной кинетической энергией, чтобы двигаться по отношению друг к другу. Молекулы движутся – жидкость течет. Молекулы не испаряются, не выпрыгивают наружу, потому что на них сверху давит воздух. О давлении воздуха я уже рассказывал. Давление, создаваемое молекулами газа, зависит от их температуры, а также от кинетической энергии. Молекулы газа находятся сверху и не позволяют молекулам жидкости выпрыгивать. Они не дают им отделиться друг от друга и превратиться в газ. Чем больше давление, тем сложнее молекулам сбежать. А теперь перенесем жидкость в вакуум, на поверхность Луны, где нет воздуха, и слегка встряхнем. Эти молекулы по-прежнему притягиваются друг к другу, но в отсутствие внешнего давления небольшого толчка хватит им, чтобы превратиться в газ. Чем ниже давление, тем легче жидкости, даже твердому телу стать газом. Даже твердые тела испаряются. Для этого нужно очень низкое давление. Посмотрите на левую часть графика. Это практически вакуум. Возьмите лед на поверхность Луны, в область с нужной температурой, я уверен, что там минус, но не помню, сколько именно, лед испарится, превращаясь в пар. В условиях глубокого вакуума молекулам вещества достаточно малейшего толчка, чтобы начать испаряться. И такое может произойти не только на Луне. Чтобы было понятнее, рассмотрим фазовую диаграмму двуокиси углерода. Вот она, смотрите. Это углекислый газ. Мы его выдыхаем, зеленые растения его потребляют. И это вещество при 1 атмосфере ведет себя иначе, чем вода. Обратите внимание, масштаб здесь не соблюден. Расстояния между 1 и 5 атмосферамии между пятью и семидесятью тремя на самом деле не равны между собой. Здесь тоже не выдержан масштаб. Если бы это было важно, я бы, наверное, использовал логарифмический масштаб. Но вернемся к двуокиси углерода. Вот твердая двуокись углерода, вот газ, а вот жидкое вещество. При давлении в одну атмосферу, то есть на уровне моря, например, как в Новом-Орлеане, если создать температуру -80 градусов Цельсия, двуокись углерода замерзнет. Вы с этим сталкивались. Не уверен, что его до сих пор используют в дымогенераторах, но ведь все слышали про сухой лед. Это твердая двуокись углерода. При атмосферном давлении на уровне моря при температуре -78,5 градусов он сублимируется. Сублимация – это переход из твердого состояния в жидкое. Запишу это. Поэтому не существует такого вещества, как жидкая двуокись углерода. Я такого никогда не видел. Чтобы сделать двуокись углерода жидкой, нужно давление в 5 атмосфер, то есть в 5 раз выше, чем давление на уровне моря. Такое возможно на Юпитере или Сатурне, где давление огромное из-за гравитации и толщины атмосферы. Жидкая двуокись углерода встречается в естественных условиях на газовых планетах-гигантах. А на Земле сухой лед возгоняется. Это синоним для сублимации. Из твердого состояния в газообразное, минуя жидкость. Есть еще кое-то интересное, и вы уже могли это заметить. Эта точка называется тройной, потому что при пяти атмосферах и минус 56 градусах Цельсия двуокись углерода находится в состоянии равновесия между льдом, жидкостью и газом. Понемногу в каждом из них. Можно подтолкнуть вещество в сторону одного из состояний, изменив условия. А вот тройная точка для воды. При давлении ниже, чем атмосферное. Это 611 паскаль, что где-то в 200 раз меньше, чем одна атмосфера. При таком давлении и температуре чуть выше 0 расположена тройная точка воды. Здесь вода находится в равновесии между этими тремя состояниями. Есть еще одна интересная точка – здесь. Критическая точка. Звучит серьезно и важно, не так ли? Если поднять температуру или давление еще выше, получится сверхкритическая жидкость. Звучит круто. Все, что дальше, – сверхкритическая жидкость. С высокой температурой и давлением. Температура делает из нее газ, но давление превращает в жидкость – это и то, и другое. Сверхкритическая вода используется как растворитель. Она ведет себя как жидкая вода, в ней можно растворять вещества, а еще она может проникать в твердые тела и просачиваться куда угодно, чтобы убрать какое-то загрязнение или растворить какую-либо соль. Сверхкритические жидкости очень интересны. И причина, по которой я показал вам эти диаграммы, в том, что давление так же может меняться, как и температура вещества. При температуре 100 градусов Цельсия или даже 110 на уровне моря вода будет газом. Вот отметка 110 градусов, и это водяной пар. Теперь увеличим значение давления, например углубимся под землю или на дно океана, и водяной пар сконденсируется в жидкость. Если переместиться в область более низких температур, можно увидеть явление, обратное сублимации. Вроде бы, я записывал его название. А, нет. Его нет. Оно подобно конденсации, но я забыл его название. Это переход из газообразного состояния напрямую в твердое, минуя жидкость. Польза этих диаграмм в том, что они позволяют предугадать поведение вещества при изменении давления и температуры. Subtitles by the Amara.org community
Элементы фазовой диаграммы
Тройные точки
| № | Фазы | Давление | Температура | Примечание | |||
|---|---|---|---|---|---|---|---|
| МПа | °C | K | |||||
| 1 | Пар | Вода | Лёд Ih | 611,657 Па | 0,01 | 273,16 | |
| 2 | Пар | Лёд Ih | Лёд XI | 0 | −201,0 | 72,15 | |
| 3 | Вода | Лёд Ih | Лёд III | 209,9 | −21,985 | 251,165 | |
| 4 | Лёд Ih | Лёд II | Лёд III | 212,9 | −34,7 | 238,45 | |
| 5 | Лёд II | Лёд III | Лёд V | 344,3 | −24,3 | 248,85 | |
| 6 | Лёд II | Лёд VI | Лёд XV | ~ 800 | −143 | 130 | Для D 2 O |
| 7 | Вода | Лёд III | Лёд V | 350,1 | −16,986 | 256,164 | |
| 8 | Вода | Лёд IV | Лёд XII | ~ 500-600 | ~ −6 | ~ 267 | |
| 9 | Лёд II | Лёд V | Лёд VI | ~ 620 | ~ −55 | ~ 218 | |
| 10 | Вода | Лёд V | Лёд VI | 632,4 | 0.16 | 273,32 | |
| 11 | Лёд VI | Лёд VIII | Лёд XV | ~ 1500 | −143 | 130 | Для D 2 O |
| 12 | Лёд VI | Лёд VII | Лёд VIII | 2100 | ~ 5 | ~ 278 | |
| 13 | Вода | Лёд VI | Лёд VII | 2216 | 81,85 | 355 | |
| 14 | Лёд VII | Лёд VIII | Лёд X | 62 000 | −173 | 100 | |
| 15 | Вода | Лёд VII | Лёд X | 47 000 | ~ 727 | ~ 1000 | |
Кривая сублимации льда
P = A ⋅ e x p (− B / T) , {\displaystyle P=A\cdot exp(-B/T),} A = 3 , 41 ⋅ 10 12 P a ; B = 6130 K . {\displaystyle A=3,41\cdot 10^{12}~\mathrm {Pa} ;\quad B=6130~\mathrm {K} .}
Ошибка этой формулы - не более 1 % в диапазоне температур 240-273,16 K и не более 2,5 % диапазоне температур 140-240 K.
Более точно кривая сублимации описывается формулой, рекомендованной IAPWS (англ.) русск. (англ. International Association for the Properties of Water and Steam - Международная ассоциация по изучению свойств воды и пара ) :
ln P P 0 = T 0 T ∑ i = 1 3 a i (T T 0) b i , {\displaystyle \ln {\frac {P}{P_{0}}}={\frac {T_{0}}{T}}\sum _{i=1}^{3}a_{i}\left({T \over T_{0}}\right)^{b_{i}},} P 0 = 611 , 657 P a ; T 0 = 273 , 16 K ; a 1 = − 21 , 2144006 ; b 1 = 0 , 003333333 ; a 2 = 27 , 3203819 ; b 2 = 1 , 20666667 ; a 3 = − 6 , 1059813 ; b 3 = 1 , 70333333. {\displaystyle {\begin{matrix}~P_{0}=611,657~\mathrm {Pa} ;&T_{0}=273,16~\mathrm {K} ;\\a_{1}=-21,2144006;&b_{1}=0,003333333;\\a_{2}=27,3203819;&b_{2}=1,20666667;\\a_{3}=-6,1059813;&b_{3}=1,70333333.\end{matrix}}}Кривая плавления льда Ih
P P 0 = 1 + ∑ i = 1 3 a i [ 1 − (T T 0) b i ] , {\displaystyle {\frac {P}{P_{0}}}=1+\sum _{i=1}^{3}a_{i}\left,} P 0 = 611 , 657 P a ; T 0 = 273 , 16 K ; a 1 = 1 195 393 , 37 ; b 1 = 3 , 00 ; a 2 = 80 818 , 3159 ; b 2 = 25 , 75 ; a 3 = 3 338 , 2686 ; b 3 = 103 , 75 ; {\displaystyle {\begin{matrix}~P_{0}=611,657~\mathrm {Pa} ;&T_{0}=273,16~\mathrm {K} ;\\a_{1}=1~195~393,37;&b1=3,00;\\a_{2}=80~818,3159;&b2=25,75;\\a_{3}=3~338,2686;&b3=103,75;\end{matrix}}}Кривая плавления льда III
Кривая плавления льда III начинается в точке минимальной температуры затвердевания воды (251,165 K; 208,566 МПа), где обычный лёд превращается в структурную модификацию III, и заканчивается в точке (256,164 K; 350,1 МПа), где проходит граница фаз III и V.
P P 0 = 1 − 0 , 299948 [ 1 − (T T 0) 60 ] , {\displaystyle {\frac {P}{P_{0}}}=1-0,299948\left,} P 0 = 208 , 566 M P a ; T 0 = 251 , 165 K . {\displaystyle P_{0}=208,566~\mathrm {MPa} ;\quad T_{0}=251,165~\mathrm {K} .}Кривая плавления льда V
Кривая плавления льда V начинается в точке (256,164 K; 350,1 МПа), на границе фаз III и V, и заканчивается в точке (273,31 K; 632,4 МПа), где проходит граница фаз V и VI.
P P 0 = 1 − 1 , 18721 [ 1 − (T T 0) 8 ] , {\displaystyle {\frac {P}{P_{0}}}=1-1,18721\left,} P 0 = 350 , 1 M P a ; T 0 = 256 , 164 K . {\displaystyle P_{0}=350,1~\mathrm {MPa} ;\quad T_{0}=256,164~\mathrm {K} .}Кривая плавления льда VI
Кривая плавления льда VI начинается в точке (273,31 K; 632,4 МПа), на границе фаз V и VI, и заканчивается в точке (355 K; 2216 МПа), где проходит граница фаз VI и VII.
P P 0 = 1 − 1 , 07476 [ 1 − (T T 0) 4 , 6 ] , {\displaystyle {\frac {P}{P_{0}}}=1-1,07476\left,} P 0 = 632 , 4 M P a ; T 0 = 273 , 31 K . {\displaystyle P_{0}=632,4~\mathrm {MPa} ;\quad T_{0}=273,31~\mathrm {K} .}Кривая плавления льда VII
Кривая плавления льда VII начинается в точке (355 K; 2216 МПа), на границе фаз VI и VII, и заканчивается в точке (715 K; 20,6 ГПа), где проходит граница фазы VII.
ln P P 0 = ∑ i = 1 3 a i (1 − (T T 0) b i) , {\displaystyle \ln {\frac {P}{P_{0}}}=\sum _{i=1}^{3}a_{i}\left(1-\left({T \over T_{0}}\right)^{b_{i}}\right),} P 0 = 2216 M P a ; T 0 = 355 K ; a 1 = 1 , 73683 ; b 1 = − 1 ; a 2 = − 0 , 0544606 ; b 2 = 5 ; a 3 = 8 , 06106 ⋅ 10 − 8 ; b 3 = 22. {\displaystyle {\begin{matrix}~P_{0}=2216~\mathrm {MPa} ;&T_{0}=355~\mathrm {K} ;\\a_{1}=1,73683;&b_{1}=-1;\\a_{2}=-0,0544606;&b_{2}=5;\\a_{3}=8,06106\cdot 10^{-8};&b_{3}=22.\end{matrix}}}Кривая насыщения водяного пара
Кривая насыщения водяного пара начинается в тройной точке воды (273,16 K; 611,657 Па) и заканчивается в критической точке (647,096 К; 22,064 МПа). Она показывает температуру кипения воды при указанном давлении или, что то же самое, давление насыщенного водяного пара при указанной температуре. В критической точке плотность водяного пара достигает плотности воды и, таким образом, различие между этими агрегатными состояниями исчезает.
β 2 θ 2 + n 1 β 2 θ + n 2 β 2 + n 3 β θ 2 + n 4 β θ + n 5 β + n 6 θ 2 + n 7 θ + n 8 = 0 , {\displaystyle \beta ^{2}\theta ^{2}+n_{1}\beta ^{2}\theta +n_{2}\beta ^{2}+n_{3}\beta \theta ^{2}+n_{4}\beta \theta +n_{5}\beta +n_{6}\theta ^{2}+n_{7}\theta +n_{8}=0,} θ = T T 0 + n 9 T T 0 − n 10 ; T 0 = 1 K ; {\displaystyle \theta ={T \over T_{0}}+{\frac {n_{9}}{{T \over T_{0}}-n_{10}}};\quad T_{0}=1~\mathrm {K} ;} β = (P P 0) 0 , 25 ; P 0 = 1 M P a ; {\displaystyle \beta =\left({\frac {P}{P_{0}}}\right)^{0,25};\quad P_{0}=1~\mathrm {MPa} ;} n 0 = 1 , 0 ; {\displaystyle n_{0}=1,0;} n 1 = 1167 , 0521452767 ; {\displaystyle n_{1}=1167,0521452767;} n 2 = − 724213 , 16703206 ; {\displaystyle n_{2}=-724213,16703206;} n 3 = − 17 , 073846940092 ; {\displaystyle n_{3}=-17,073846940092;} n 4 = 12020 , 82470247 ; {\displaystyle n_{4}=12020,82470247;} n 5 = − 3232555 , 0322333 ; {\displaystyle n_{5}=-3232555,0322333;} n 6 = 14 , 91510861353 ; {\displaystyle n_{6}=14,91510861353;} n 7 = − 4823 , 2657361591 ; {\displaystyle n_{7}=-4823,2657361591;} n 8 = 405113 , 40542057 ; {\displaystyle n_{8}=405113,40542057;} n 9 = − 0 , 23855557567849 ; {\displaystyle n_{9}=-0,23855557567849;} n 10 = 650 , 17534844798. {\displaystyle n_{10}=650,17534844798.}Для заданного абсолютного значения температуры T вычисляется нормированное значение θ и коэффициенты квадратного уравнения
A = θ 2 + n 1 θ + n 2 ; {\displaystyle A=\theta ^{2}+n_{1}\theta +n_{2};} B = n 3 θ 2 + n 4 θ + n 5 ; {\displaystyle B=n_{3}\theta ^{2}+n_{4}\theta +n_{5};} C = n 6 θ 2 + n 7 θ + n 8 , {\displaystyle C=n_{6}\theta ^{2}+n_{7}\theta +n_{8},}после чего находится значение β
β = − B − B 2 − 4 A C 2 A {\displaystyle \beta ={\frac {-B-{\sqrt {B^{2}-4AC}}}{2A}}}и абсолютное значение давления:
P = P 0 β 4 . {\displaystyle P=P_{0}\beta ^{4}.}Давление насыщенного водяного пара (кПа) при различных температурах
| T °C | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 0,6112 | 0,6571 | 0,7060 | 0,7581 | 0,8135 | 0,8726 | 0,9354 | 1,002 | 1,073 | 1,148 |
| 10 | 1,228 | 1,313 | 1,403 | 1,498 | 1,599 | 1,706 | 1,819 | 1,938 | 2,065 | 2,198 |
| 20 | 2,339 | 2,488 | 2,645 | 2,811 | 2,986 | 3,170 | 3,364 | 3,568 | 3,783 | 4,009 |
| 30 | 4,247 | 4,497 | 4,759 | 5,035 | 5,325 | 5,629 | 5,947 | 6,282 | 6,632 | 7,000 |
| 40 | 7,384 | 7,787 | 8,209 | 8,650 | 9,112 | 9,594 | 10,10 | 10,63 | 11,18 | 11,75 |
| 50 | 12,35 | 12,98 | 13,63 | 14,31 | 15,02 | 15,76 | 16,53 | 17,33 | 18,17 | 19,04 |
| 60 | 19,95 | 20,89 | 21,87 | 22,88 | 23,94 | 25,04 | 26,18 | 27,37 | 28,60 | 29,88 |
| 70 | 31,20 | 32,57 | 34,00 | 35,48 | 37,01 | 38,60 | 40,24 | 41,94 | 43,70 | 45,53 |
| 80 | 47,41 | 49,37 | 51,39 | 53,48 | 55,64 | 57,87 | 60,17 | 62,56 | 65,02 | 67,56 |
| 90 | 70,18 | 72,89 | 75,68 | 78,57 | 81,54 | 84,61 | 87,77 | 91,03 | 94,39 | 97,85 |
| 100 | 101,4 |
См. также
Ссылки
- IAPWS . Сайт Международной ассоциации по изучению свойств воды.
Эта диаграмма показана на рис. 6.5. Области фазовой диаграммы, ограниченные кривыми, соответствуют тем условиям (температурам и давлениям), при которых устойчива только одна фаза вещества. Например, при любых значениях температуры и давления, которые соответствуют точкам диаграммы, ограниченным кривыми ВТ и ТС, вода существует в жидком состоянии. При любых температуре и давлении, соответствующих точкам диаграммы, которые расположены ниже кривых АТ и ТС, вода существует в парообразном состоянии.
Кривые фазовой диаграммы соответствуют условиям, при которых какие-либо две фазы находятся в равновесии друг с другом. Например, при температурах и давлениях, соответствующих точкам кривой ТС, вода и ее пар находятся в равновесии. Это и есть кривая давления пара воды (см. рис. 3.13). В точке X на этой кривой жидкая вода и пар находятся в равновесии при температуре 373 К (100 °С) и давлении 1 атм (101,325 кПа); точка X представляет собой точку кипения воды при давлении 1 атм.
Кривая АТ является кривой давления пара льда; такую кривую обычно называют кривой сублимации.
Кривая ВТ представляет собой кривую плавления. Она показывает, как давление влияет на температуру плавления льда: если давление возрастает, температура плавления немного уменьшается. Такая зависимость температуры плавления от давления встречается редко. Обычно возрастание давления благоприятствует образованию твердого вещества, как мы убедимся на примере рассматриваемой далее фазовой диаграммы диоксида углерода. В случае воды повышение давления приводит к разрушению водородных связей, которые в кристалле льда связывают между собой молекулы воды, заставляя их образовывать громоздкую структуру. В результате
Рис. 6.5. Фазовая диаграмма воды.
разрушения водородных связей происходит образование более плотной жидкой фазы (см. разд. 2.2).
В точке У на кривой ВТ лед находится в равновесии с водой при температуре 273 К (0 °С) и давлении 1 атм. Она представляет собой точку замерзания воды при давлении 1 атм.
Кривая ST указывает давление пара воды при температурах ниже ее точки замерзания. Поскольку вода в нормальных условиях не существует в виде жидкости при температурах ниже ее точки замерзания, каждая точка на этой кривой соответствует воде, находящейся в метастабилъном состоянии. Это означает, что при соответствующих температуре и давлении вода находится не в своем наиболее устойчивом (стабильном) состоянии. Явление, которое соответствует существованию воды в метастабилъном состоянии, описываемом точками этой кривой, называется переохлаждением.
На фазовой диаграмме имеются две точки, представляющие особый интерес. Прежде всего отметим, что кривая давления пара воды заканчивается точкой С. Она называется критической точкой воды. При температурах и давлениях выше этой точки пары воды не могут быть превращены в жидкую воду никаким повышением давления (см. также разд. 3.1). Другими словами, выше этой точки паровая и жидкая формы воды перестают быть различимыми. Критическая температура воды равна 647 К, а критическое давление составляет 220 атм.
Точка Т фазовой диаграммы называется тройной точкой. В этой точке лед, жидкая вода и пары воды находятся в равновесии друг с другом. Этой точке соответствуют температура 273,16 К и давление атм. Лишь при указанных значениях температуры и давления все три фазы воды могут существовать вместе, находясь в равновесии друг с другом.
Иней может образовываться двумя способами: из росы либо непосредственно из влажного воздуха.
Образование инея из росы. Роса - это вода, образующаяся при охлаждении влажного воздуха, когда его температура понижается, пересекая (при атмосферном давлении) кривую ТС на рис. 6.5. Иней образуется в результате замерзания росы, когда температура понижается настолько, что пересекает кривую ВТ.
Образование инея непосредственно из влажного воздуха. Иней образуется из росы только в том случае, если давление пара воды превышает давление тройной точки Т, т.е. больше атм. Если же давление паров воды меньше этого значения, иней образуется непосредственно из влажного воздуха, без предварительного образования росы. В таком случае он появляется, когда понижающаяся температура пересекает кривую на рис. 6.5. В этих условиях образуется сухой иней.

Состояния воды .
Вода может находиться в трех агрегатных состояниях, или фазах,- твердом (лед), жидком (собственно вода), газообразном (водяной пар). Очень важно, что при реально существующих на Земле диапазонах атмосферного давления и температуры вода может находиться одновременно в разных агрегатных состояниях. В этом отношении вода существенно отличается от других физических веществ, находящихся в естественных условиях преимущественно либо в твердом (минералы, металлы), либо в газообразном (О 2 , N 2 , СО 2 и т.д.) состоянии.
Изменения агрегатного состояния вещества называют фазовыми переходами. В этих случаях свойства вещества (например, плотность) скачкообразно изменяются. Фазовые переходы сопровождаются выделением или поглощением энергии, называемой теплотой фазового перехода («скрытой теплотой»).
Зависимость агрегатного состояния воды от давления и температуры выражается диаграммой состояния воды, или фазовой диаграммой (рис. 5.1.1.).
Кривая ВВ"О на рис 5.1.1. носит название кривой плавления. При переходе через эту кривую слева направо происходит плавление
Рис. 5.1.1. Диаграмма состояния воды
I – VIII - различные модификации льда
льда, а справа налево - ледообразование (кристаллизация воды). Кривая ОК называется кривой парообразования. При переходе через эту кривую слева направо наблюдается кипение воды, а справа налево - конденсация водяного пара. Кривая АО носит название кривой сублимации, или кривой возгонки. При пересечении ее слева направо происходит испарение льда (возгонка), а справа налево - конденсация в твердую фазу (или сублимация).
В точке О (так называемой тройной точке, при давлении 610 Па и температуре 0,01° С или 273,16 К) вода одновременно находится во всех трех агрегатных состояниях.
Температура, при которой происходит плавление льда (или кристаллизация воды), называется температурой или точкой плавления Т пл. Эту температуру можно называть также температурой или точкой замерзания Т зам.
С поверхности воды, а также льда и снега постоянно отрывается и уносится в воздух некоторое количество молекул, образующих молекулы водяного пара. Одновременно с этим часть молекул водяного пара возвращается обратно на поверхность воды, снега и льда. Если преобладает первый процесс, то идет испарение воды, если второй - конденсация водяного пара. Регулятором направленности и интенсивности этих процессов служит дефицит влажности - разность упругости водяного пара, насыщающего пространство при данных давлении воздуха и температуре поверхности воды (снега, льда), и упругости фактически содержащегося в воздухе водяного пара, т.е. абсолютной влажности воздуха. Содержание в воздухе насыщенного водяного пара и его упругость увеличиваются с ростом температуры (при нормальном давлении) следующим образом. При температуре О°С содержание и упругость насыщенного водяного пара равны соответственно 4,856 г/м3 и 6,1078 гПа, при температуре 20°С - 30,380 г/м3 и 23,373 гПа, при 40°С - 51,127 г/м3 и 73,777 гПа.
Испарение с поверхности воды (льда, снега), а также влажной почвы идет при любой температуре и тем интенсивнее, чем больше дефицит влажности. С ростом температуры упругость водяного пара, насыщающего пространство, растет, и испарение ускоряется. К увеличению испарения приводит и возрастание скорости движения воздуха над испаряющей поверхностью (т.е. скорости ветра в природных условиях), усиливающее интенсивность вертикального массо- и теплообмена.
Когда интенсивное испарение охватывает не только свободную поверхность воды, но и ее толщу, где испарение идет с внутренней поверхности образующихся при этом пузырьков, начинается процесс кипения. Температура, при которой давление насыщенного водяного пара равно внешнему давлению, называется температурой или точкой кипения T кип.
При нормальном атмосферном давлении (1,013 105 Па = 1,013 бар = 1 атм = 760 мм рт. ст.) точки замерзания воды (плавления льда) и кипения (конденсации) соответствуют по шкале Цельсия 0 и 100°.
Температура замерзания Т зам и температура кипения воды Т кип зависят от давления (см. рис. 3.9.2.). В диапазоне изменения давления от 610 до 1,013 105 Па (или 1 атм) температура замерзания немного понижается (от 0,01 до 0° С), затем при росте давления приблизительно до 6 107 Па (600 атм) Т зам падает до -5° С, при увеличении давления до 2,2 108 Па (2 200 атм) Т зам уменьшается до -22° С. При дальнейшем увеличении давления Т зам начинает быстро возрастать. При очень большом давлении образуются особые «модификации» льда (II-VIII), отличающиеся по своим свойствам от обычного льда (льда I).
При реальном атмосферном давлении на Земле пресная вода замерзает при температуре около 0° С. На максимальных глубинах в океане (около 11 км) давление превышает 108 Па, или 1 000 атм (увеличение глубины на каждые 10 м увеличивает давление приблизительно на 105 Па, или 1 атм). При таком давлении температура замерзания пресной воды была бы около -12° С.
На снижение температуры замерзания воды

оказывает влияние ее соленость.
1.4). Увеличение солености на каждые 10‰ снижает Т зам приблизительно на 0,54° С:
Т зам = -0,054 S.
Температура кипения с уменьшением давления снижается (см. рис. 3.9.2.). Поэтому на больших высотах в горах вода кипит при температуре ниже, чем 100° С. При росте давления Т кип возрастает до так называемой «критической точки», когда при р = 2,2 107 Па и Т кип = 374° С вода одновременно имеет свойства и жидкости и газа.
Диаграмма состояния воды иллюстрирует две «аномалии» воды, оказывающие решающее влияние не только на «поведение» воды на Земле, но и на природные условия планеты в целом. По сравнению с веществами, представляющими собой соединения водорода с элементами, находящимися в Периодической таблице Менделеева в одном ряду с кислородом,- теллуром Те, селеном Se и серой S, температура замерзания и кипения воды необычно высока. Учитывая закономерную связь температуры замерзания и кипения с массовым числом упомянутых веществ, следовало бы ожидать у воды значения температуры замерзания около -90° С, а температуры кипения около -70° С. Аномально высокие значения температуры замерзания и кипения предопределяют возможность существования воды на планете как в твердом, так и в жидком состоянии и служат определяющими условиями основных гидрологических и других природных процессов на Земле.
Плотность воды
Плотность - главнейшая физическая характеристика любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу его объема:
где m - масса, V - объем. Плотность р имеет размерность кг/м 3 .
Плотность воды, как и других веществ, зависит прежде всего от температуры и давления (а для природных вод - еще и от содержания растворенных и тонкодисперсных взвешенных веществ) и скачкообразно изменяется при фазовых переходах.. При повышении температуры плотность воды, как и любого другого вещества, в большей части диапазона изменения температуры уменьшается, что связано с увеличением расстояния между молекулами при росте температуры. Эта закономерность нарушается лишь при плавлении льда и при нагревании воды в диапазоне от 0 до 4° (точнее 3,98° С). Здесь отмечаются еще две очень важные «анатомии» воды: 1) плотность воды в твердом состоянии (лед) меньше, чем в жидком (вода), чего нет у подавляющего большинства других веществ; 2) в диапазоне температуры воды от 0 до 4° С плотность воды с повышением температуры не уменьшается, а увеличивается. Особенности изменения плотности воды связаны с перестройкой молекулярной структуры воды. Эти две «аномалии» воды имеют огромное гидрологическое значение: лед легче воды и поэтому «плавает» на ее поверхности; водоемы обычно не промерзают до дна, так как охлажденная до температуры ниже 4° пресная вода становится менее плотной и поэтому остается в поверхностном слое.
Плотность льда зависит от его структуры и температуры. Пористый лед может иметь плотность, намного меньшую, чем указано в таблице1.1. Еще меньше плотность снега. Свежевыпавший снег имеет плотность 80-140 кг/м 3 ,плотность слежавшегося снега постепенно увеличивается от 140-300 (до начала таяния) до 240-350 (в начале таяния) и 300-450 кг/м 3 (в конце таяния). Плотный мокрый снег может иметь плотность до 600-700 кг/м 3 . Снежинки во время таяния имеют плотность 400-600, лавинный снег 500-650 кг/м 3 . Слой воды, образующийся при таянии льда и снега, зависит от толщины слоя льда или снега и их плотности. Запас воды в льде или в снеге равен:
h в = ah л р л /р
где h л - толщина слоя льда или снега, р л - их плотность, р - плотность воды, а - множитель, определяемый соотношением размерностей h в и h л: если слой воды выражается в мм, а толщина льда (снега) в см, то а=10, при одинаковой размерности а=1.
Плотность воды изменяется также в зависимости от содержания в ней растворенных веществ и увеличивается с ростом солености (рис. 1.5). Плотность морской воды при нормальном давлении может достигать 1025-1033 кг/м 3 .
Совместное влияние температуры и солености на плотность воды при атмосферном давлении выражают с помощью так называемого уравнения состояния морской воды. Такое уравнение в самом простом линейном виде записывают следующим образом:
р = р о (1 - α 1 Т + α 2 S)
где Т - температура воды, °С, S - соленость воды, ‰, р о - плотность воды при Т = 0 и S = 0, α 1 и α 2 - параметры.
Увеличение солености приводит также к понижению температуры наибольшей плотности (°С) согласно формуле
Т наиб.пл = 4 - 0,215 S.

Рис. 5.2.1. Зависимость плотности воды при нормальном атмосферном давлении от температуры и солености воды.
Увеличение солености на каждые 10‰ снижает Т наиб.пл приблизительно на 2° С. Зависимость температуры наибольшей плотности и температуры замерзания от солености воды иллюстрирует так называемый график Хелланд-Хансена (см. рис. 3.10.1.).
Соотношения между температурами наибольшей плотности и замерзания влияют на характер процесса охлаждения воды и вертикальной конвекции - перемешивания, обусловленного различиями в плотности. Охлаждение воды в результате теплообмена с воздухом приводит к увеличению плотности воды и, соответственно, к опусканию более плотной воды вниз. На ее место поднимаются более теплые и менее плотные воды. Происходит процесс вертикальной плотностной конвекции. Однако для пресных и солоноватых вод, имеющих соленость менее 24,7‰, такой процесс продолжается лишь до момента достижения водой температуры наибольшей плотности (см. рис. 1.4). Дальнейшее охлаждение воды ведет к уменьшению ее плотности, и вертикальная конвекция прекращается. Соленые воды при S>24,7‰ подвержены вертикальной конвекции вплоть до момента их замерзания.
Таким образом, в пресных или солоноватых водах зимой в придонных горизонтах температура воды оказывается выше, чем на поверхности, и, согласно графику Хелланд-Хансена, всегда выше температуры замерзания. Это обстоятельство имеет огромное значение для сохранения жизни в водоемах на глубинах. Если бы у воды температуры наибольшей плотности и замерзания совпадали бы, как у всех других жидкостей, то водоемы могли промерзать до дна, вызывая неизбежную гибель большинства организмов.
«Аномальное» изменение плотности воды при изменении температуры влечет за собой такое же «аномальное» изменение объема воды: с возрастанием температуры от 0 до 4° С объем химически чистой воды уменьшается, и лишь при дальнейшем повышении температуры - увеличивается; объем льда всегда заметно больше объема той же массы воды (вспомним, как лопаются трубы при замерзании воды).
Изменение объема воды при изменении ее температуры может быть выражено формулой
V T1 = V T2 (1 + β DT)
где V T1 - объем воды при температуре Т1, V T2 - объем воды при T2, β - коэффициент объемного расширения, принимающий отрицательные значения при температуре от 0 до 4° С и положительные при температуре воды больше 4° С и меньше 0° С (лед) (см. табл. 1.1),
Некоторое влияние на плотность воды оказывает также и давление. Сжимаемость воды очень мала, но она на больших глубинах в океане все же сказывается на плотности воды. На каждые 1000 м глубины плотность вследствие влияния давления столба воды возрастает на 4,5-4,9 кг/м 3 . Поэтому на максимальных океанских глубинах (около 11 км) плотность воды будет приблизительно на 48 кг/м 3 больше, чем на поверхности, и при S = 35‰ составит около 1076 кг/м 3 . Если бы вода была совершенно несжимаемой, уровень Мирового океана был бы на 30 м выше, чем в действительности. Малая сжимаемость воды позволяет существенно упростить гидродинамический анализ движения природных вод.
Влияние мелких взвешенных наносов на физические характеристики воды и, в частности, на ее плотность изучено еще недостаточно. Считают, что на плотность воды могут оказывать влияние лишь очень мелкие взвеси при их исключительно большой концентрации, когда воду и наносы уже нельзя рассматривать изолированно. Так, некоторые виды селей, содержащие лишь 20-30% воды, представляют собой по существу глинистый раствор с повышенной плотностью. Другим примером влияния мелких наносов на плотность могут служить воды Хуанхэ, втекающие в залив Желтого моря. При очень большом содержании мелких наносов (до 220 кг/м 3) речные мутные воды имеют плотность на 2-2,5 кг/м 3 больше, чем морские воды (их плотность при фактической солености и температуре около 1018 кг/м 3). Поэтому они «ныряют» на глубину и опускаются по морскому дну, формируя «плотный», или «мутьевой», поток.